Sacculinisierung
In seiner Diskussion der gerichteten Evolution wies Konrad Lorenz, der Nobelpreisträger und einer der Begründer der modernen Verhaltenslehre (Ethologie) darauf hin, dass die Evolution von jedem Entwicklungssstadium aus in jeder beliebigen Richtung erfolgen kann, abhängig vom jeweiligen Selektiondruck [1]. Er illustrierte dies mit dem Prozess der retrograden (regressiven) Evolution bei bestimmten Parasiten, wofür er den Ausdruck “Sacculinisierung” einführte. Der Ausdruck stammt von dem parasitischen Krebstier Sacculina, dessen freilebende Larven denen anderer Krebstiere (Crustacea) ähneln, d.h. sie besitzen gegliederte Anhänge wie zum Beispiel auch die des Flusskrebses. Die Anhänge verschwinden, nachdem die Larven Krabben infiziert haben. Übrig bleibt ein aussen sichtbarer sackartiger Anhang auf der Bauchseite des Abdomens des Wirtes, die sogenannte Externa, welche die Gonaden enthält. Auswüchse der Externa wachsen in die Gewebe der Krabben, wo sie Nährstoffe durch ihre Oberfläche aufnehmen (Abbildung 1). Derartige “degenerierte” Formen sind bei vielen parasitären Krebstieren und Schnecken häufig. Zum Beispiel ist auch ein anderes Krebstier, die Assel (Isopoda)Danalia curvata, ein Hyperparasit (d.h. ein Parasit eines Parasiten) vonSacculina, ebenfalls zu einem sackartigem Anhang rückgebildet (Abbildung 1). Unter den Schnecken sind gewisse Arten Endoparasiten (Parasiten im Inneren eines Wirtes) von Seegurken (Holothuria); sie besitzen eine wurmartige Gestalt ohne jede äussere Ähnlichkeit mit normalen Schnecken (Abbildung 1).

Abbildung 1. Eine parasitäre Schnecke in einer Seegurke; die hyperparasitäre Assel Danalia curvata auf dem parasitären KrebstierSacculinaauf der Bauchseite einer Krabbe; und Sacculina: beachte die unregelmässigen Auswüchse der Externa von Sacculina im Inneren der Krabbe. Nur die hintersten Teile der Krabbe sind illustriert. Original Klaus Rohde. © Klaus Rohde
Die Aspidogastrea. Zunahme der Komplexität
Es wird fast allgemein angenommen, dass Parasiten tatsächlich immer in irgendeiner Hinsicht degeneriert sind. Dies ist jedoch nicht der Fall, im Gegenteil, ein gegensätzlicher Trend ist für Arten einer Trematodengruppe, die Aspidogastrea nachgewiesen worden. Intensive licht- und elektronenmikroskopische Untersuchungen an einigen Arten der Aspidogastrea, insbesondere Lobatostoma manteri und Multicotyle purvisi, haben eine erstaunliche Vielfalt von Sinnesrezeptoren nachgewiesen, von denen einige in sehr grosser Zahl vorkommen. Sowohl die Vielfalt wie auch die Zahl der Rezeptoren ist grösser als in verwandten freilebenden Plattwürmern, den Turbellarien. Ebenso ist das Nervensystem der untersuchten Aspidogastrea komplexer.
Die Morphologie und Lebenszyklen der Aspidogastrea wurden in zwei anderen knol besprochen.

Abbildung 2. Rasterelektronenmikroskopische Aufnahme des Vorderendes vonMulticalyx elegans. Original Klaus Rohde. © Klaus Rohde
Transmissions-Elektronenmikroskopie
Mit dem Transmissions-Elektronenmikroskop kann man nicht nur oberflächliche, sondern auch innere Strukturen untersuchen. Vergleich von ultradünnen Serienschnitten hat gezeigt, dass juvenile/adulte Lobatostoma manteri mindestens 8 und möglicherweise bis zu 14 Rezeptorentypen besitzen, zu unterscheiden auf der Basis des Vorhandenseins oder nicht einer Wimper (Cilium) und ihrer Länge, des Vorhandenseins oder nicht einer Wimperwurzel und ihrer Länge und Form, der Zahl der Microtubuli im Axonem, und ob der Rezeptor Teil eines komplexen Organes ist [6]. Juvenile/adulte Multicotyle haben 7 und möglicherweise bis zu 9 Rezeptorentypen. Einige der hauptsächlichen Typen von L. manteri sind im folgenden durch elektronenmikroskopische Aufnahmen einzelner Schnitte illustriert, obwohl Serienschnitte zur Unterscheidung der Rezeptorentypen benutzt wurden. Alle Rezeptoren sind die differenzierten Endabschnitte von Dendriten (Nervenfasern), die im allgemeinen Wimperstrukturen enthalten. Zum Beispiel hat der Rezeptor in Abbildung 3 eine kurze Wimper im Dendriten, eingebettet in der Oberflächenschicht des Wurmes, d.h. in seinem Tegument. Typische Wimpern besitzen ein Axonem mit einer 9+2 Struktur, d.h. es enthält 9 Paare (doublets) von Microtubuli in der Peripherie und 2 einzelne Microtubuli im Zentrum (Abbildung 4). Doch gibt es auch abweichende Muster. So stellt Abbildung 5 einen Schnitt durch einen ähnlichen Rezeptor dar, jedoch durch eine etwas andere Schnittebene. Sie zeigt Strukturen, die in Abbildung 3 nicht vorhanden sind, nämlich den Basalkörper an der Basis der Wimper, und eine anders geformte Wimperwurzel.

Abbildung 3.Bewimperter Oberflächenrezeptor von Lobatostoma manteri. Terminale dendritische Verdickung mit einer einzigen Wimper. Original Klaus Rohde. © Klaus Rohde

Abbildung 4. Querschnitt durch eine Wimper eines Sinnesrezeptoren. Beachte die 9+2 Struktur (neun Paare von Microtubuli in der Peripherie, zwei einzelne Microtubuli in der Mitte). Original Klaus Rohde. © Klaus Rohde

Abbildung 5. Oberflächenrezeptor von Lobatostome manteri. Beachte die Wimper mit Basalkörper, Wimperwurzel, Mitochondria und Vesikeln, und tiefe Einstülpungen des Tegumentes in den Dendriten. Original Klaus Rohde. © Klaus Rohde
In einem anderen Rezeptorentyp fehlt eine freie Wimper und die Wimperwurzel ist scheibenartig vergrössert (Abbildung 6).

Abbildung 6. Rezeptor von Lobatostoma manteri ohne freie Wimper, jedoch mit vergrösserter Wimperwurzel. Beachte auch die Schnitte durch die dichten “Kragen” im oberen Teil des Dendriten. Original Klaus Rohde. © Klaus Rohde

Abbildung 7. Rezeptor unter der Oberfläche von Lobatostoma manteri. Beachte die gut entwickelte Wimperwurzel. Serienschnitte zeigen, dass eine durch die Oberfläche dringende Wimper fehlt. Original Klaus Rohde. © Klaus Rohde

Abbildung 8. Wimperloser Rezeptor von Lobatostoma manteri in einer tiefen Grube des Teguments, mit einer verzweigten Wimperwurzel. Original Klaus Rohde. © Klaus Rohde .
Elektronenmikroskopische Untersuchungen an Multicotyle purvisi [7] zeigten die folgenden Rezeptorentypen, in vieler Hinsicht denen von Lobatostoma manteri ähnelnd, dennoch in einigen Merkmalen verschieden: 1) scheibenartiger Rezeptor mit vielen Krägen und einer zu einer Scheibe umgebildeten Wimperwurzel; 2) wimperloser Rezeptor mit langer Wurzel; 3) wimperloser Rezeptor mit verzweigter Wurzel und einer dichten Menge von unregelmässig angeordneten Microtubuli; 4) wimperloser Rezeptor mit einer sich vom Basalkörper her ausbreitenden Wurzel, die im oberen Teil quergestreift ist und im unteren Teil elektronendichte Strukturen enthält; 5) Rezeptor mit einer einzigen Wimper und einer dicken Cytoplasma-Schicht um das Axonem herum; 6) Rezeptor mit kurzer Wimper, am Grunde einer tiefen Grube im Tegument; 7) Rezeptor mit kurzer Wimper, die mit einer elektronendichten Kappe endigt; 8) Rezeptor mit langer Wimper.
Ausserdem können vielleicht ein kleiner unbewimperter Rezeptor mit langer Wimperwurzel an der Basis des dicken dorsalen Tegumentes, und ein Rezeptor mit einer einzigen langen Wimper unterschieden werden, der sich von 8 durch die Anzahl der Krägen und die Länge der Wurzel und Wimper unterscheidet.

Abbildung 9. Nervensystem von Multicotyle purvisi im vorderen Körperteil. Einige Nerven auf der rechten Körperseite sind angeschnitten, um die Anordnung der Nerven im Querschnitt zu zeigen. Beachte die zwei Kommissuren-Ringe, das grosse Gehirn (Cerebralkommissur) und das dicke ventrale Konnektiv (rot). Original Klaus Rohde. © Klaus Rohde

Abbildung 10. Nervensystem von Multicotyle purvisi im mittleren Körperabschnitt mit dem typischen Muster von Konnectiven und Kommissuren im dorsalen Körperteil, und einem komplexen System die ventrale Saugscheibe innervierender Nerven. Original Klaus Rohde. © Klaus Rohde
Ein dichter Nervenplexus innerviert den Darm (Abbildung 11), und ein weiterer das aus Bindegewebe bestehende Septum, das den dorsalen Körperteil von der Saugscheibe trennt.

Abbildung 11. Nervenplexus um den Darm von Multicotyle purvisi, dargestellt in einem mit Silber imprägnierten Schnitt unter dem Lichtmikroskop. Original Klaus Rohde. © Klaus Rohde
Transmissions-Elektronenmikroskopie zeigte eine aus Lamellen bestehende Scheide um Teile des hinteren Konnectivs [11] , nicht bekannt von anderen Platyhelminthen.

Abbildung 12. Transmissions-Elektronenmikroskopie des Ocellus (Auges) larvaler Multicotyle purvisi. Beachte die Pigmentzelle mit Pigmentgranula, Zellkern der Pigmentzelle, und Rhabdomer (licht-sensitive dendritische Endigungen). Original Klaus Rohde. © Klaus Rohde
Die Larve von Lobatostoma manteri besitzt nur etwa 9 Rezeptortypen: Augen fehlen, und vordere Rezeptorkomplexe fehlen ebenfalls. Der Unterschied zwischen den Larven beider Arten kann nur erklärt werden durch die Art, wie sie den Zwischenwirt infizieren. Die letztere Art schlüpt nicht, sondern wird durch die Schnecke gefressen, die erstere Art schlüpft, schwimmt im Wasser, reagiert auf Lichtreize, und wird dann durch den Wirt inhaliert.
Das Nervensystem larvaler Multicotyle wurde rekonstruiert mit Hilfe von Silber-imprägnierten Serienschnitten. Es zeigt das gleiche Grundmuster wie im adulten Wurm, mit den Pharynx, Darm und hinteren Saugnapf innervierenden Nerven, und einer grossen Zahl vorderer Konnective [10] .
Die Komplexität der Rezeptoren und des Nervensystems freilebender Plattwürmer
Eine beträchtliche Zahl von Arbeiten über verschiedene Rezeptoren freilebender Turbellarian (Platyhelminthes) ist erschienen, doch in nur wenigen wurde versucht, ein komplettes “Sensogramm”, d.h. ein vollständiges Inventar der Rezeptoren bestimmter Arten zu bestimmen. Nur Luriculus australiensis, eine kleine Art aus der Meiofauna australischer Küsten [18], und Macrostomum cf. bulbostylum aus dem Süswasser [19] wurden in dieser Hinsicht untersucht. Für eine Art der Acoela wurden von Smith and Tyler (1986) [20]9 Rezeptorentypen nachgewiesen, doch werden die Acoeomorpha jetzt als ein eigenes Phylum angesehen, d.h. sie sind nicht Platyhelminthes. Luriculus australiensis (Länge etwat 0.15mm) hat 9 Typen von Rezeptoren mit einer einzigen Wimper; ihre Zahl wurde nicht bestimmt, doch ist sie sicherlich viel geringer als die der Aspidogastrea. Macrostomum (Länge etwa 2 mm) besitzt 9 Rezeptortypen einschliesslich einem Photorezeptor (Auge). Die Gesamtzahl der Rezeptoren wurde als “grösser als 300” geschätzt, d.h. sie ist bedeutend geringer als die von Lobatostoma (viele 1000). Die Statocyste (Gleichgewichtsorgan) (Abbildungen 13 und 14), die charakteristisch fürLuriculusist, wurde nicht untersucht [18]. Sie erhöht die Gesamtzahl der Rezeptoren dieser Art auf 10. – Das Nervensystem der vielen untersuchte Turbellarienarten ist weniger komplex als das von Multicotyle purvisi.

Abbildung 13. Statocyste von Luriculus australiensis unter dem Transmissions-Elektronenmikroskop. Beachte die drei grossen Kalkkörper(Statolithen)in der mit Flüsigkeit gefüllten Höhle. Original Klaus Rohde.© Klaus Rohde
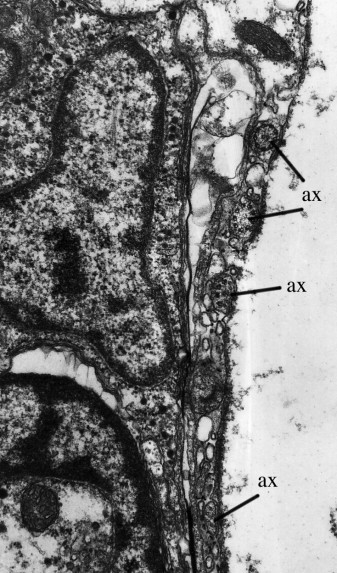
Abbildung 14. Transmissions-elektronenmikroskopische Aufnahme der Statocystenwand vonLuriculus australiensis. Beachte die Axoneme (ax), die die sensorischen Elemente der Statocyste darstellen. Original Klaus Rohde. © Klaus Rohde
Schlussfolgerung
Die hier dargestellten Befunde zeigen, dass die Vielfalt der Rezeptorentypen einiger Aspidogastrea mindestens ebenso gross und möglicherweise grösser ist als die freilebender Plattwürmer; die Gesamtzahl der Rezeptoren ist viel grösser, nur zum Teil erklärt durch die Körpergrösse der Aspidogastrea. Die Komplexität des Nervensystems ist ebenfalls grösser. Es ist klar, das nicht Sacculinisierung als Folge der parasitären Lebensweise, sondern der gegensätzliche Trend vorliegt. Mögliche Gründe hierfür werden in einem weiteren Knol über die Aspidogastrea diskutiert.
Literatur
Lorenz, K. 1983. Der Abbau des Menschlichen. Piper, München, Rohde, K. 1966. Sense receptors of Multicotyle purvisi Dawes (Trematoda, Aspidobothria). Nature, 211, 820-822.
Rohde, K. 1968. Lichtmikroskopische Untersuchungen an den Sinnesrezeptoren der Trematoden. Zeitschrift für Parasitenkunde 30, 252-277.
Rohde, K. 1972. The Aspidogastrea, especially Multicotyle purvisi Dawes, 1941. Advances in Parasitology, 10, 77-151.
Rohde, K. 1973. Structure and development of Lobatostoma manteri sp. nov. (Trematoda, Aspidogastrea) from the Great Barrier Reef, Australia. Parasitology, 66, 63-83.
Rohde, K. 1989. At least eight types of sense receptors in an endoparasitic flatworm: a counter-trend to sacculinization. Naturwissenschaften, 76, 383-385.
Rohde, K. 1990. Ultrastructure of the sense receptors of adult Multicotyle purvisi (Trematoda, Aspidogastrea). Zoologica Scripta, 19, 233-241.
Rohde, K. 1968. Vergleichende Untersuchungen über das Nervensystem der Trematoden (Digenea, Aspidogastrea, Monogenea). Zeitschrift für Parasitenkunde, 31, 12-13.
Rohde, K. 1968. The nervous systems of Multicotyle purvisi Dawes, 1941 (Aspidogastrea) and Diaschistorchis multitesticularis Rohde, 1962 (Digenea). Implications for the ecology of the parasites. Zeitschrift für Parasitenkunde, 30, 78-94.
Rohde, K. 1971. Untersuchungen an Multicotyle purvisi Dawes, 1941 (Trematoda, Aspidogastrea). III. Licht- und elecktronenmikroskopischer Bau des Nervensystems. Zoologische Jahrbücher, Abteilung für Anatomie, 88, 320-363.
Rohde, K. 1970. Nerve sheath in Multicotyle purvisi Dawes. Naturwissenschaften, 57, 502-503.
Rohde, K. and Watson, N. 1990. Non-ciliate sensory receptors of larval Multicotyle purvisi (Trematoda, Aspidogastrea). Parasitology Research, 76, 585-590.
Rohde, K. and Watson, N. 1990. Uniciliate sensory receptors of larval Multicotyle purvisi (Trematoda, Aspidogastrea). Parasitology Research, 76, 591-596.
Rohde, K. and Watson. 1990. Paired multiciliate receptor complexes in larval Multicotyle purvisi (Trematoda, Aspidogastrea). Parasitology Research, 76, 597-601.
Rohde, K. and Watson, N.A. 1992. Sense receptors of larval Lobatostoma manteri (Trematoda, Aspidogastrea). International Journal for Parasitology, 22, 35-42.
Rohde, K. 1994. The minor groups of parasitic Platyhelminthes. Advances in Parasitology, 33, 145-234.
Rohde, K. 1999. Aspidogastrea, In Tree of Life (eds. Maddison, D.R. and Maddison, W.P.).http://tolweb.org/tree?group=Aspidogastrea&contgroup=Platyhelminthes
Rohde, K. and Watson, N.A. 1993. Ultrastructure of sensory receptors of an undescribed species of Luridae (Platyhelminthes: Rhabdocoela). Australian Journal of Zoology, 41, 53-65.
Xylander, W.E.R., Rohde K .and Watson, N.A. 1997. Ultrastructural investigations of the sensory receptors of Macrostomum cf. bulbostylum (Platyhelminthes, Macrostomida). Zoologischer Anzeiger, 236, 1-12.
Smith, J.P.S. and Tyler, S. 1986. Frontal organs in the Acoelomorpha (Turbellaria): ultrastructure and phylogenetic significance. Hydrobiologia 132, 71-78.
Anonymous
On the date akin to such it is always a so large joy to interpret your writingKamagra 100 / cialis / phentermine / levitra